SHP2成药之旅:破局、热潮、遇冷与希望
来源:医药魔方 2024-10-14 11:48
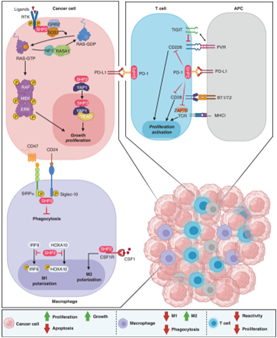
SHP在肿瘤中的作用机制
然而,SHP2抑制剂的开发却不是一件容易的事情,高度同源的同家族成员(如SHP1和PTP1B)会使其缺乏选择性,而且SHP2结构中的PTP结构域往往带有正电荷,更倾向于结合带负电的分子,而带负电荷的小分子抑制剂本身在代谢和生物利用度方面处于弱势。这也一度使得SHP2成为“不可成药”靶点。
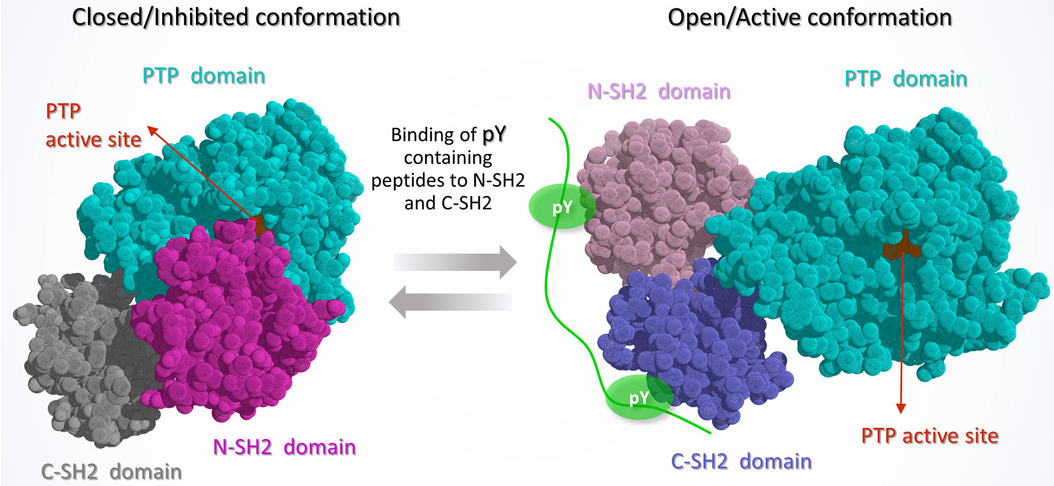
SHP2的抑制和活性构象及3个结构域示意图
破局:诺华开启SHP2研发新篇章
2016年,诺华在Nature上报道了一款SHP2变构抑制剂SHP099,它能结合到SHP2蛋白的3个结构域之间,使SHP2稳定在抑制状态,从而抑制SHP2的活性。这一变构抑制剂的突破性发现开启了SHP2药物研发的新篇章。
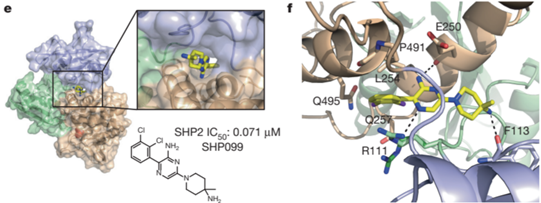
诺华SHP2变构抑制剂SHP099
在SHP099结构基础上,诺华不断优化,得到了4个SHP2变构抑制剂的临床前候选化合物(SHP244、SHP389、SHP394和TNO155)。之后不到一年的时间内,诺华就将最优的候选化合物TNO155推进至临床研究阶段。2017年4月,TNO155成为了全球首个开展人体临床试验的SHP2抑制剂。
诺华在SHP2靶点上的突破激发了行业对这一赛道的广泛关注,中国企业加科思以及制药巨头赛诺菲也看中了SHP2的潜力,开始积极进行布局。
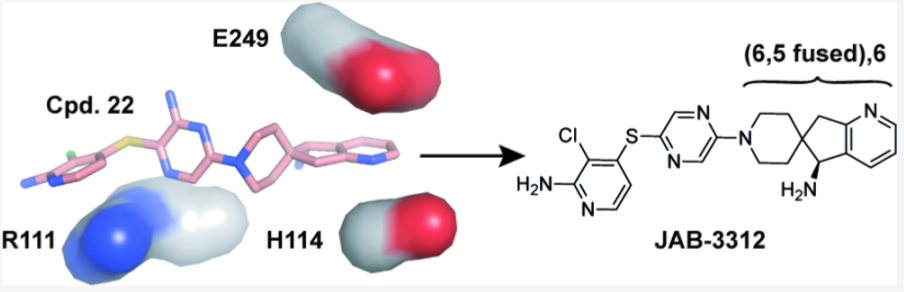
2018年1月,加科思的一代SHP2变构抑制剂JAB-3068首次提交IND,同年启动多项I期临床项目。一年之后,加科思又推出了二代SHP2变构抑制剂JAB-3312。2019年7月,JAB-3312首次提交IND,加科思在攻克SHP2成药之路上迈出了新的一步。这两款SHP2抑制剂也一度引起了艾伯维的关注。2020年6月,艾伯维以4500万美元首付款,8.1亿美元里程碑付款和一定比例销售分成将JAB-3068和JAB-3312的海外权益收入囊中(目前已退回)。
2018年7月,赛诺菲以5000万美元预付款+超5亿美元开发和注册里程碑付款与Revolution Medicines达成合作,获得了还处于临床前研究阶段的SHP2变构抑制剂RMC-4630(vociprotafib)。1个月后,RMC-4630首个I期临床研究(NCT03634982)启动,随后赛诺菲/Revolution陆续开展了RMC-4630联用上下游KRAS G12C抑制剂(sotorasib/adagrasib)、ERK抑制剂(LY3214996)或MEK抑制剂(cobimetinib)及PD-1抑制剂(K药)在非小细胞肺癌(NSCLC)、结直肠癌(CRC)、胰腺导管腺癌(PDAC)等实体瘤中的临床研究。
SHP2研发热潮:巨头收购,中国企业密集入场
2020-2021年间,针对SHP2的新药研发进入爆发时期,11款SHP2抑制剂相继进入临床开发阶段,其中7款来自中国公司。同时,艾伯维、罗氏等公司纷纷收购SHP2抑制剂,引发重磅交易,而此前进行的SHP2抑制剂的初步临床研究也披露出积极数据,这无疑让人们对这一靶点更有信心。
AACR 2020大会上,赛诺菲的RMC-4630+ cobimetinib(MEK抑制剂)组合已在KRAS突变CRC患者中观察到初步的抗肿瘤活性;AACR 2021大会上,RMC-4630单药在KRAS G12C突变的NSCLC患者中的疾病控制率(DCR)达75%(12/16)。
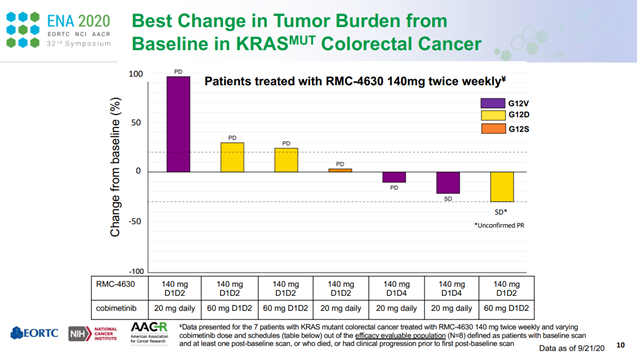
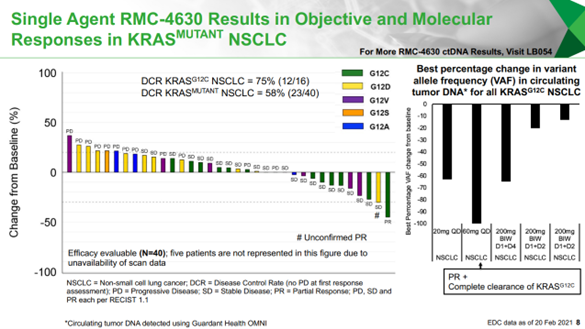
ASCO 2021大会上,诺华TNO155单药治疗晚期实体瘤患者的首个I期临床研究结果公布,TNO155表现出良好的药代动力学特性,且具有较好安全性和耐受性,22%的患者疾病稳定(SD),SD的中位持续时间为5.6个月。并且该药可以阻断下游Ras-Raf-MEK-ERK通路,减少免疫微环境中的免疫抑制信号,这再次验证了SHP2抑制剂的作用机制,为其与KRAS抑制剂或PD-1抑制剂的联用提供了更多证据支持。
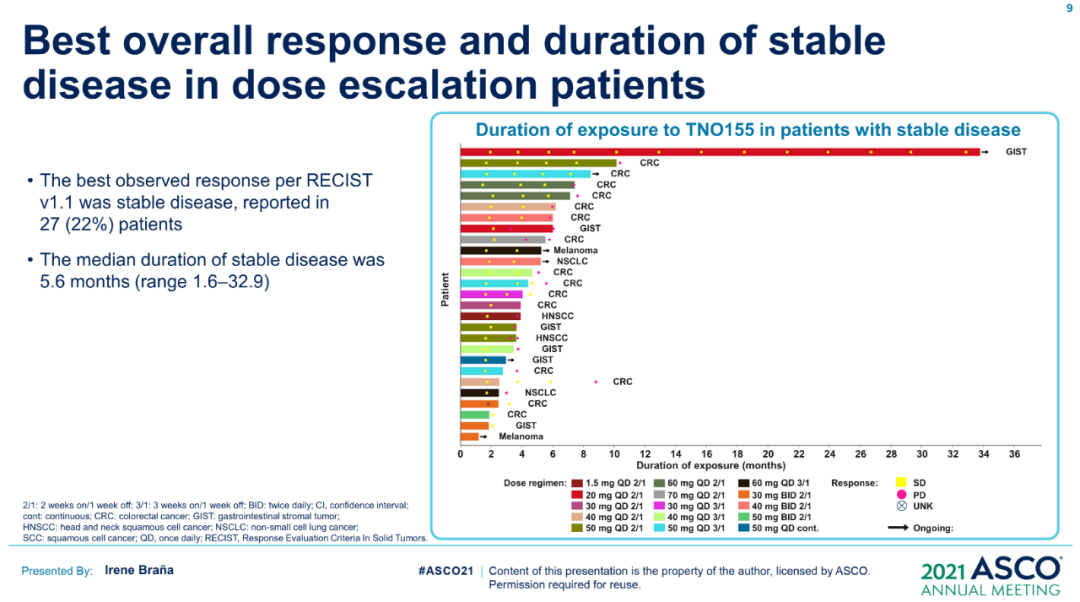
诺华随即开启了TNO155组合疗法的探索,对自家的KRAS G12C抑制剂(JDQ443)、PD-1抑制剂(spartalizumab)、BRAF抑制剂(达拉非尼)、CDK4/6抑制剂(瑞波西利)分别做出尝试,希望增强疗效或减少耐药。
彼时SHP2大热,罗氏手握KRAS G12C抑制剂GDC-6036(divarasib),也十分看好KRAS G12C+SHP2组合未来的潜力,2020年12月,罗氏旗下基因泰克以7500万美元首付款、2500万美元近期付款以及6.95亿美元里程碑付款获得了Relay Therapeutics公司SHP2变构抑制剂RLY-1971(GDC-1971,migoprotafib)的全球开发和商业化权益。随后罗氏还开启了GDC-1971联合阿替利珠单抗、奥希替尼或西妥昔单抗的多项早期临床研究。
2020年8月,BridgeBio开发的SHP2抑制剂BBP-398也进入了I期临床。BBP-398最初由BridgeBio与MD Anderson Cancer Center(德州大学安德森癌症中心)合作开发,2022年5月,BMS以9000万美元的预付款,高达8.15亿美元的里程碑付款及分级特许权使用费获得了该药的独家开发和商业化许可协议,BMS显然也是为自己的O药和KRAS G12C抑制剂adagrasib寻找理想搭档。
BBP-398在中国大陆和其他亚洲市场的权益则归联拓生物所有。临床前研究证明了该SHP2抑制剂可以克服奥希替尼的耐药。联拓生物将BBP-398与奥希替尼联用,评估该组合治疗NSCLC患者的疗效和安全性。
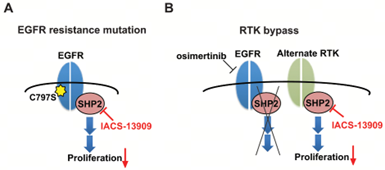
BBP-398(图中IACS-13909)克服奥希替尼耐药机制示意图
2020年12月,又一款SHP2变构抑制剂ERAS-601进入IND,而不到一个月内,Erasca就迅速将其买下,紧接着开启了ERAS-601与EGFR、ERK、KRAS等靶点药物的联合用药探索。
2021年3月,辉瑞的SHP2变构抑制剂PF-07284892进入I期临床,采用联合治疗策略,将PF-07284892分别与ALK/ROS1抑制剂洛拉替尼、BRAF抑制剂恩考芬尼+EGFR抑制剂西妥昔单抗或MEK抑制剂binimetinib联用,在不同的晚期实体瘤患者中,评估其疗效和安全性。
2020和2021年也是中国企业扎堆进入SHP2赛道的爆发期,圣和药业、青峰医药、奕拓医药、凌达生物、翰森制药、勤浩医药、贝达药业相继提交各自的国产SHP2抑制剂的IND申请。不过国内企业并未开展多项SHP2抑制剂与其他药物联用的临床研究,除了勤浩医药与青峰医药外,大多数企业仅启动SHP2抑制剂单药治疗实体瘤的早期临床研究。
风云突变:制药巨头“退货”给SHP2热潮降温
好景不长,SHP2研发投资的热潮伴随着制药巨头“退货”动作的出现戛然而止。
2022年12月,赛诺菲退还RMC-4630的所有权益,尽管早期临床研究证据表明,RMC-4630单药或联合上下游KRAS G12C/MEK抑制剂可能带来临床获益,却依然被退回,这不免令人对其成药前景生疑。虽然赛诺菲未明确披露退货理由,但我们或许可以从同年8月公布的RMC-4630联合sotorasib(KRAS G12C抑制剂)治疗晚期KRAS G12C突变的NSCLC的Ib期研究数据中窥见端倪。该研究结果显示在所有接受联合治疗的患者(n=11)中,3例出现部分缓解(PR,27%),4例病情稳定(SD,36%),疾病控制率(DCR)为64%(n=7)。尽管是早期研究的疗效数据,但27%的ORR或许还不足以满足赛诺菲对两药联合的疗效期待。
虽然Revolution会继续开发该药物,但是Revolution的研发重点在于3款RAS抑制剂(RMC-6236、RMC-6291、RMC-9805),对于RMC-4630的定位是“RAS伴侣(RAS Companion Inhibitors)”,后续研发取决于项目组合优先级决策。
2023年7月,艾伯维基于资产组合与战略决策原因终止了与加科思的SHP2抑制剂的所有合作,这再次释放出一个危险信号。在此之前公布的I期临床结果显示,接受JAB-3068单药治疗的晚期实体瘤患者有39.1%(9/23)达到SD,虽然在全人群中疗效有限,但加科思发现了“JAB-3068在PD-(L)1耐药背景下的疗效信号令人鼓舞”,在接受过PD-(L)1治疗的患者中有62.5%(5/8)达到SD,之后该公司开启了JAB-3068与特瑞普利单抗联用的临床研究。然而今年8月份,加科思宣布终止了JAB-3068的临床开发,加科思第一代SHP2抑制剂的开发就此落幕。
今年7月,罗氏无理由终止了与Relay的合作,退还了该公司的SHP2抑制剂GDC-1971,后者在一个月后公布的Q2财报中表示不会再继续开发GDC-1971。关于该药的多项I期临床研究,两家公司尚未披露任何结果,就这样这场不到4年的合作无疾而终,虽然其中的原由和隐秘不为外人知晓,但这一举动更加引发了行业对SHP2药物成药的担忧。
同样是在今年7月份,SHP2领域的“先驱”—诺华在2024Q2财报中披露终止TNO155的II期临床研究,TNO155在其管线中消失,诺华大概率也不会再继续开发该药。从现有披露的临床数据来看,或许疗效才是TNO155被放弃的关键原因。
TNO155联合spartalizumab(PD-1抑制剂)或瑞波西利治疗晚期实体瘤的I期研究(NCT03114319)结果显示,57例患者接受TNO155+spartalizumab治疗,其中1例PR,13例SD,28例PD,剩下15例不可评估(NE);46例患者接受TNO155+瑞波西利治疗,其中6例SD,31例PD,9例NE,两组联合药物治疗组合的ORR均未超过25%。另一项TNO155+JDQ443(KRAS G12C抑制剂)在晚期KRAS G12C突变的实体瘤中的Ib/II期临床研究(NCT04699188)结果显示,50例患者接受了JDQ443+TNO155的剂量递增治疗,在12例既往接受过 KRAS G12C抑制剂治疗的且反应可评估的NSCLC患者中,ORR为33.3%(4/12),DCR为66.7%(8/12),显示出初步的抗肿瘤活性。
不仅如此,其他两家开发SHP2抑制剂的公司BMS和Erasca也终止了多项临床研究。
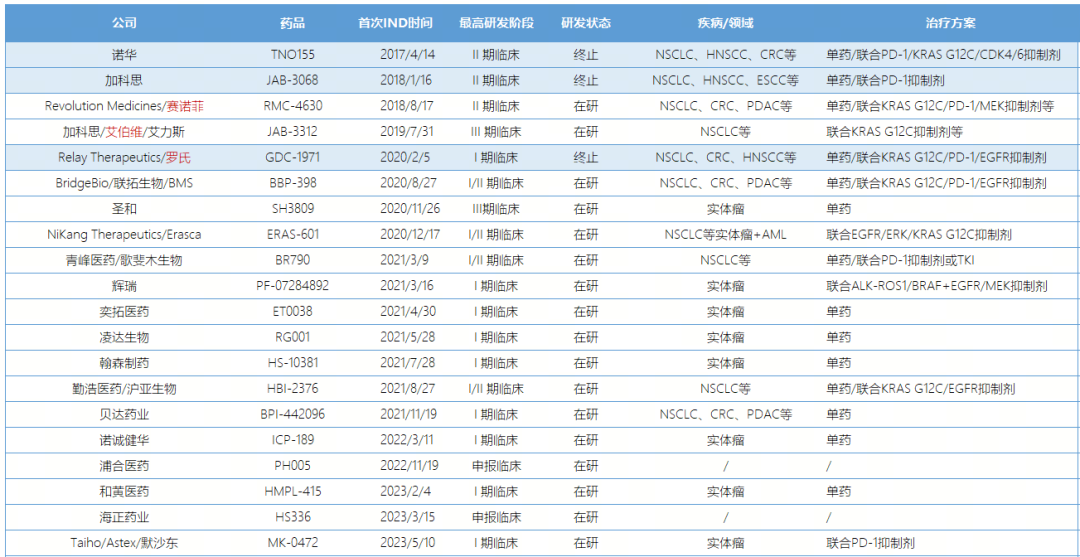 进入临床研究阶段的SHP2抑制剂(红色为退回权益的公司)
进入临床研究阶段的SHP2抑制剂(红色为退回权益的公司)
新希望:加科思SHP2 +KRAS G12C组合带来转机
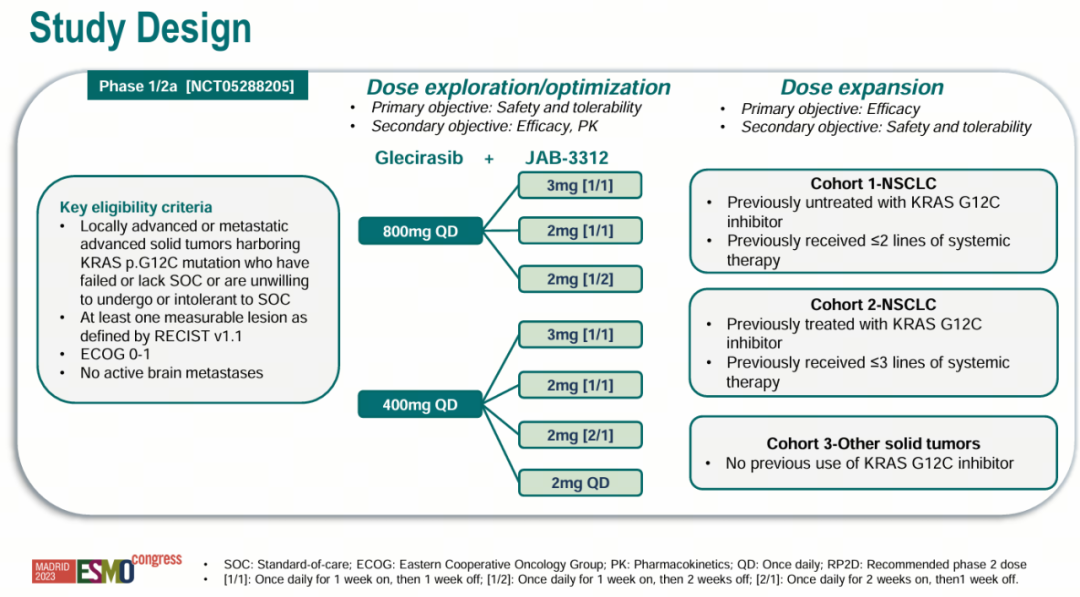
制药巨头一系列退货、离场的负面消息给SHP2抑制剂的开发泼了一盆冷水,但加科思一项JAB-3312+戈来雷塞(KRAS G12C抑制剂)的I/IIa期临床研究的(NCT05288205)积极结果又让业界看到了新的希望。
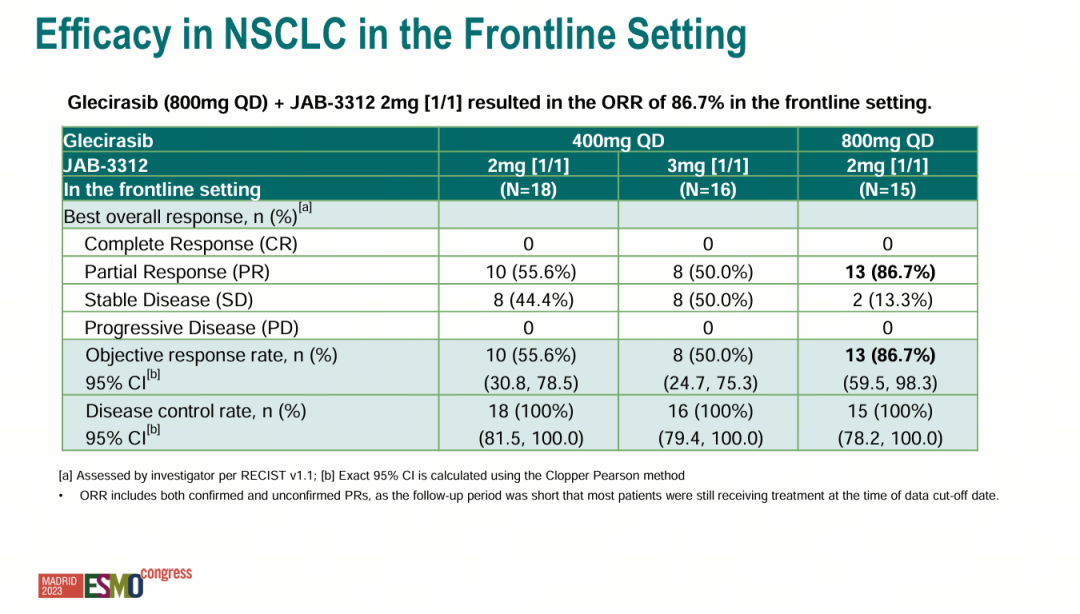
针对KRAS p.G12C突变实体瘤患者的I/IIa期研究(NCT05288205)结果表明,在所有剂量组的晚期NSCLC患者中,该组合一线治疗的ORR(客观缓解率)是65.5%(38/58),DCR(疾病控制率)是 100% 。其中在800mg戈来雷塞(每日给药一次)及2mg JAB-3312(给药1周间歇1周)联用的剂量组中,ORR为86.7%(13/15),DCR为 100%。
ASCO 2024更新的随访数据显示,一线NSCLC患者共入组102例,分布在7个剂量组,确认客观缓解率(cORR)为64.7%(66/102),疾病控制率(DCR)为93.1%(95/102),中位无进展生存期(mPFS)为12.2个月。最优剂量组为800mg戈来雷塞与2mg JAB-3312联用(JAB-3312给药一周,停药一周),cORR为77.4%(24/31),54.8%(17/31)的患者肿瘤缩小超过50%,达到深度缓解,mPFS尚未成熟,且安全性可控。
基于此,加科思还在在今年5月启动了JAB-3312+戈来雷塞对比替雷利珠单抗联合培美曲塞+卡铂一线治疗KRAS p.G12C突变的晚期非鳞状非小细胞肺癌的随机、阳性对照、开放标签、多中心的注册性III期临床研究,8月份该研究已完成首例患者给药。JAB-3312成为全球首个进入III期临床研究的SHP2抑制剂,若JAB-3312+戈来雷塞组合能在后续的III期临床中优于现有的标准疗法(免疫疗法联合化疗),SHP2抑制剂将有望获得批准上市。
今年8月底,艾力斯向加科思支付1.5亿元首付款,最高达7.0亿元的开发及销售里程碑付款,以及两位数比例的销售提成,获得在中国研究、开发、生产、注册以及商业化戈来雷塞和JAB-3312的独占许可,这无疑是看到了SHP2抑制剂的潜在价值。
从现有数据来看,目前SHP2抑制剂单药疗效有限,联合疗法可能是未来的大势所趋,包括KRAS G12C、PD-1、EGFR抑制剂等。加科思的SHP2+KRAS组合已表现出显著的疗效结果,后续III期临床也已启动,JAB-3312未来可期。2022年5月,BMS开启了SHP2抑制剂BBP-398联合O药治疗KRAS突变的晚期NSCLC的I期临床研究;2023年5月,默沙东也展开其SHP2抑制剂MK-0472与K药联用治疗晚期或转移性实体瘤的I期临床。SHP2抑制剂与PD-1组合能否再次有所突破?答案将随着时间的流逝而揭晓。
结语
任何一个新靶点的成药之路都充满了希望,但也不乏挑战和起伏,例如SHP2下游靶点KRAS,也一度被认为是“不可成药”靶点,但是科学的进步和研发人员的努力,使KRAS G12C抑制剂得以成功上市,为患者带来了新的治疗希望。
SHP2从发现到“难以成药”,再到后来变构抑制剂的出现打破僵局,经历了业界药企的“追捧”和“遇冷”,直至现在步入III期临床,其成药之旅也是一波三折,但正是医药研发人员迎难而上和坚持不懈地对该靶点的持续探索,为药物的成功开发点燃了希望之光。我们满怀期待,盼望着这些努力能够在未来开花结果,迎来首款药物成功上市的辉煌时刻。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


